

细胞与基因治疗开发之路繁琐复杂,充满诸多不确定性,物料、工艺、质量、合规等风险均可能影响产品的开发申报、临床应用甚至于商业化进程。药明工艺开发团队拥有丰富的工艺开发及临床申报经验,为客户提供产品设计定义、质量属性确定、工艺路线规划、物料工艺风险评估、设计空间、工艺优化、工程化、确认、放大及转移等服务,助力加速为客户提供完成项目的早期开发设计,排除工艺开发风险,开发适用于不同阶段的生产工艺,在符合监管要求的同时控制生产成本,确保您的项目按时达成里程碑目标。
2.服务内容:
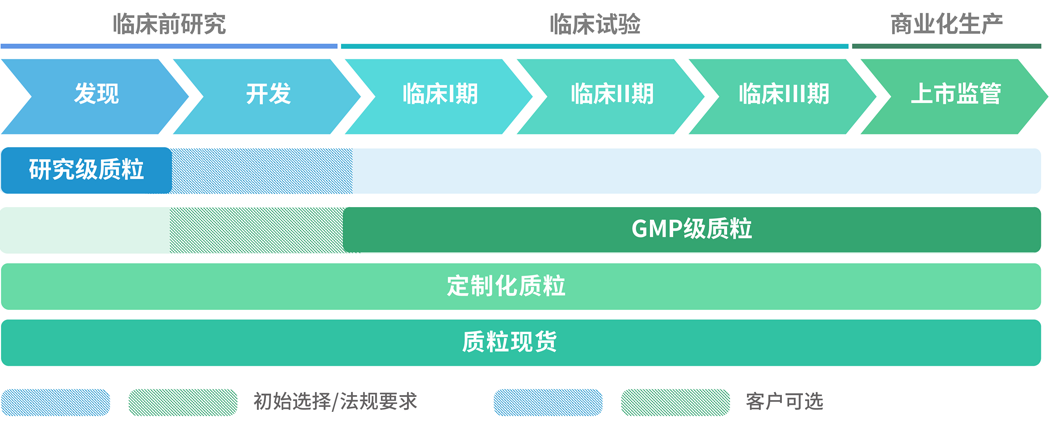
(1)质粒DNA开发:为客户提供从质粒菌种构建、克隆筛选、菌种建库、工艺开发、非临床研究级别质粒生产到临床用GMP级别质粒生产的全方位、一体化定制服务。
质粒菌种建库流程:
质粒菌种库工艺开发流程:
(2)病毒载体开发:病毒载体作为一种安全、高效的基因递送手段,已广泛应用于细胞与基因治疗领域。目前最常用的病毒载体包括非复制生产型病毒载体(慢病毒载体-LVV、腺相关病毒载体-AAV等)和可复制生产型病毒载体(溶瘤单纯疱疹病毒-OHSV、腺病毒载体-ADV等)。 我司提供从病毒载体构建、细胞库建立、工艺开发、规模放大、GMP生产到方法开发、质量检测放行等全方位、高度灵活定制化的一站式CTDMO(Contract, Testing, Development and Manufacturing Organization)服务。
贴壁工艺典型流程:
悬浮工艺典型流程:
(3)免疫细胞开发:工艺适用于各种来源的细胞(如外周血、脐带血、骨髓、脂肪等),细胞治疗产品业务范围包括CAR-T,TCR-T,NK,DC等免疫细胞治疗产品工艺开发及放大、分析方法开发与质量研究、临床样品生产与放行。
CAR-T细胞治疗产品开发流程:
DC细胞治疗产品开发流程:
(4)产品定义设计
- · 充分了解产品原型治疗定位及设计作用机理
- · 梳理已有工艺及非临床数据
- · 结合我们的开发经验,协助优化产品设计
(5)质量属性鉴定
- · 基于产品目标质量概况
- · 结合已有数据及工艺理解、科学认知
- · 协助定义产品关键质量属性
(6)工艺路线设计
- · 充分理解实验室工艺
- · 结合工艺开发经验
- · 基于QbD理念进行质量风险管理和工艺路线设计
(7)风险评估
- · 评估关键原材料对产品质量的影响,相应进行物料管理
- · 评估关键工艺参数对产品质量的影响,相应进行试验设计
(8)工艺优化
- · 根据风险评估结果定义设计空间及参数范围
- · 根据实验结果调整工艺
- · 确定设计空间
- · 根据需求进行中试工艺开发
(9)工艺确认/验证
- · 设施设备及性能确认
- · 锁定实验室工艺路线及参数
- · 持续工艺确认和偏差纠正预防
- · 建立工艺控制策略
3.适用范围:
质粒,慢病毒、腺相关病毒载体,腺病毒、单纯疱疹病毒等溶瘤病毒,免疫细胞等
4.服务流程:
客户需求-方案沟通-询价-合同-付款-实验-报告发布
5.收费标准:
面议
6.服务团队:
在该专业领域拥有数十年经验的工艺开发团队,可为您提供全方位的工艺开发服务。
上海药明康德新药开发有限公司拥有OECD和NMPA双认证的GLP临床前实验室、OECD以及NMPA认证的GLP/GCP生物分析实验室等赋能平台。 科技创新券服务涵盖化学药研发、生物学研究、临床前测试等领域,通过独特的“CRDMO”和“CTDMO”业务模式,不断降低研发门槛,助力客户提升研发效率。